 2021-06-09
2021-06-09 4115
4115
关键词:老年性痴呆;治疗药物
2021年6月7日,美国食品和药品管理局(FDA)批准美国百健(Biogen)公司的aducanumab用于阿尔茨海默病(AD,即老年性痴呆)早期阶段的治疗。
这是第一个获得批准的能够延缓AD进展的药物,也是近20年来,FDA新批准的另外一个治疗AD的药物。
从药物研发和科研角度,aducanumab的批准,也成为证明去除Aβ蛋白可带来更好的临床结果的首个疗法,将继续推动这方面的研发。
这个消息立即引爆美国媒体。因为,这个批准太重要了!
"We have to really temper expectations"
(我们必须真正降低期望值)
尽管对于aducanumab治疗AD的疗效一直充满着争议,尤其是在2020年FDA组织的专家委员会对该药物的投票中,在针对aducanumab治疗早期AD的证据是否充分时,专家有10票认为不充分、1票不确定,0票认为证据充分;但今天,FDA还是批准了aducanumab。
对此,威尔康奈尔大学阿尔茨海默并预防诊所主任Richard Isaacson博士说:
“我们必须真正降低期望值,并向人们解释,批准的aducanumab只适用于最早的症状阶段。”

人类苦AD久矣!
阿尔茨海默病(AD)是最常见的中枢神经系统变性病,是第六常见的死亡原因,更是第二常见的慢性病。在60岁以上的老年人中患病率达5%,给患者本人和家庭造成了极大的痛苦和负担。
朋友圈每个月都会出现的寻找丢失失智老人的信息,时刻提醒着我们AD给人类带来的痛苦。
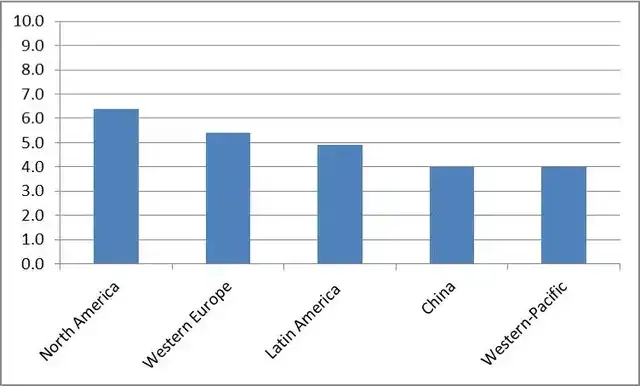
(来源:Biochem Pharmacol, 2014)
尽管AD在全球影响约5000万人,各国科学家都在为尽快找到AD的治疗药物而努力,但从2002年到目前,近20年的时间内,欧美国家尚未有新批准治疗AD的药物。
并且,即使已经批准的药物,也只是针对AD的发病机制进行的改善症状治疗,而无一延缓疾病进展的药物。
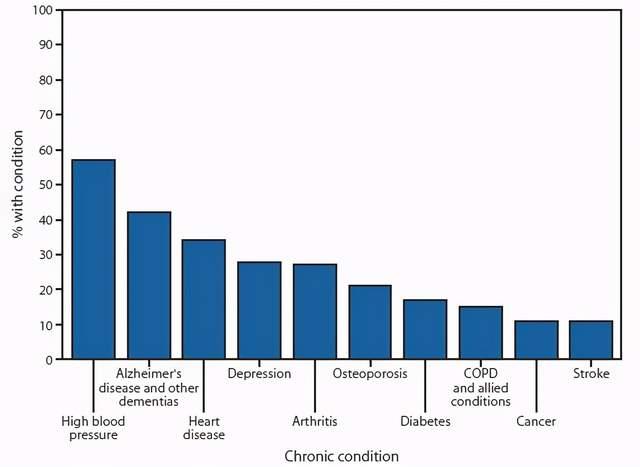
(图源:美国CDC)
而为了攻克AD,从1998年起至今,全球累计研发投入超过6000亿美元,据不完全统计,公开宣布的研发失败至少有154次。
包括辉瑞、礼来、罗氏、默沙东、阿斯利康、默克等知名制药公司,均在AD药物研究中投入过巨额资金,但均宣布失败或者不得不终止研究。
aducanumab治疗AD,
真的行吗?
美国Biogen公司的aducanumab研发和寻求FDA批准过程,同样充满坎坷和争议。
Aducanumab(BIIB037)是一种人源单克隆抗体,能够选择性结合大脑的淀粉样蛋白(Aβ)斑块,让小胶质细胞将这些斑块清除。
根据合作开发和许可协议,百健从Neurimmune引进了aducanumab。自2017年10月以来,百健和卫材在全球范围内合作开展了aducanumab的开发和商业化。
但是,美国百健公司联合日本卫材公司于2019年3月21日宣布,提前终止百健公司开发的β淀粉样蛋白(Aβ)抗体aducanumab治疗阿兹海默症患者的3期临床试验。
终止原因主要是,aducanumab对于AD以及轻度AD引起的轻度认知功能损伤没有改善作用,很可能难以到达主要疗效终点。
关键时候,生物统计师出场。
Biogen的统计师基于对之前aducanumab治疗AD患者的两项全球III期研究的重新分析。这两项研究分别是ENGAGE和EMERGE临床试验。
在新分析中,aducanumab疗效达到其预先设定的主要终点。
接受高剂量aducanumab治疗的AD患者在18个月时的临床痴呆评分总和量表(CDR-SB)评分较基线水平明显降低(与安慰剂相比降低23%,P = 0.01)。
高剂量aducanumab治疗的AD患者还显示出次要终点的持续减少。次要终点事件包括:轻度精神状态检查(MMSE;15%vs安慰剂,P = 0.06),AD评估量表-认知子量表13项(ADAS-Cog 13;27%vs安慰剂,P = 0.01),以及日常生活轻度认知障碍版本的AD合作研究活动(ADCS-ADL-MCI;40%vs安慰剂,P = 0.001)。
根据这个结果,2019年10月22日,百健(Biogen)和日本卫材(Eisai)宣布:
在与FDA协商后,百健计划将在2020年初向FDA提交阿尔茨海默病药物aducanumab的生物制品许可上市申请(BLA);并将继续与欧洲、日本等地区的监管机构进行协商。
主导两项研究的总负责人,罗切斯特大学AD护理研究和教育计划(AD-CARE)主任Anton Porsteinsson博士表示,
“该药物具有巨大的未满足的医疗需求,阿尔茨海默病患者一直在等待这一刻。我赞扬百健、FDA、医学界以及患者及其研究伙伴的不懈努力,让今天的公告成为现实。”
2020年7月,Biogen完成了FDA提交的生物制品许可申请。
此后,就是漫长的等待。
AD研究人员、医生,众多的AD患者及其家属,都在焦虑地等待FDA的决定。。。
而过程同样惊心动魄。很多组织给FDA写信,认为不能批准aducanumab治疗AD,因为缺乏证据。
而更多组织,如阿尔茨海默病协会,则支持批准该药。
就在上周五,阿尔茨海默病协会的网站指出:
“无论FDA的最终决定是什么,这都是一个重要的时刻。我们之前从未如此接近过一种治疗AD的药物。这个药物可以改变疾病的进展,而不仅仅是症状。”

终于批准了!
对于被诊断为轻度认知障碍的病人及其家属来说,aducanumab带来了希望。
作为参加过aducanumab临床试验的患者,69岁的Jenny Knap说:
“我确定认为,总体而言,我在找到我的眼镜在哪里方面做得更好”。
编者按:
再次感谢生物医学研究人员,不断提供着更好的药物,改善着人类的生活质量。
aducanumab的批准,是老年性痴呆治疗上的突破,必将造福AD患者及其家庭。
但也需要看到,尽管在AD治疗中确实有了真正的突破,但是仍远远不能满足AD患者所需。这也只是一个美好的开始,更多更好的药物研发上市,实属必要。
特别需要指出的是,重新统计分析,对于aducanumab的新生起到关键的扭转作用;而生物分析也往往能够找到被大家忽视的信息。生物统计一直是在美国华裔的特长之一,很高兴这些朋友为生物医学发展做出的贡献。
版权声明:本文转自“Hanson临床科研”,文章转载只为学术传播,不代表本号观点,无商业用途,版权归原作者所有,如涉及侵权问题,请联系我们,我们将及时修改或删除。
 学术互动
学术互动

添加微信获取最新优惠、出版政策、课程直播信息,随时咨询客服/编辑,了解更多实时资讯


