 2021-07-24
2021-07-24 4016
4016
大家好!今天跟大家分享的文献时2021年4月发表在Cell Death Discovery(IF=5.241)杂志上的一篇文献。文章利用TCGA队列和GEO队列构建了一个用于预测OC的7-焦亡相关基因风险模型。
题目:A novel defined pyroptosis-related gene signature for predicting the prognosis of ovarian cancer
用于预测卵巢癌预后的一种新型焦亡相关基因特征
摘要
卵巢癌(OC)是一种高度恶性的妇科肿瘤,预后较差。近年来,已有研究表明焦亡是程序性细胞死亡的炎症。然而,OC中焦亡相关基因和其预后的关系尚不清楚。本研究中,作者鉴定到31个差异表达的焦亡调控因子。根据这些DEGs将OC分为两个亚型。使用TCGA队列和LASSO Cox回归方法构建一个7-焦亡相关基因预后特征,将TCGA队列分为高风险组和低风险组。低风险组OC患者生存率较高。根据TCGA队列风险打分的中位数,可以将GEO队列分为两个风险亚组,低风险组的OS显著增加。风险打分是OC患者的预后独立因子。GO和KEGG分析表明,高风险组的患者免疫相关基因富集且免疫状态活性较低。总的来说,焦亡相关基因在肿瘤免疫中发挥重要作用,可以用于预测OC预后。
流程图
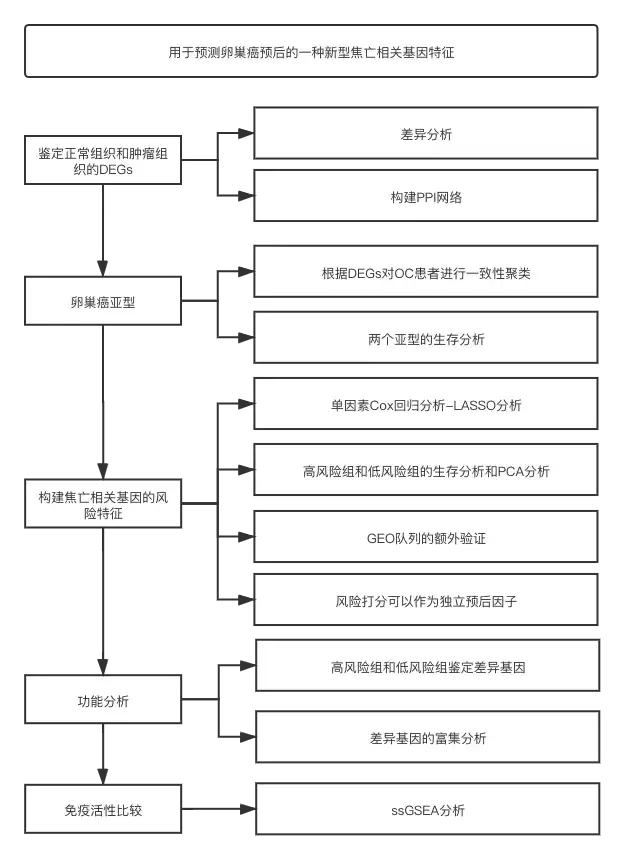
结果
1. 数据集的获取和下载
从TCGA数据库下载379例OC患者的RNA-seq数据,从GTEx数据库下载88个正常卵巢组织的RNA-seq数据。从GEO数据库下载的RNA-seq数据和临床数据作为额外的验证队列。
2. 鉴定正常组织和肿瘤组织的DEGs
对正常组织和肿瘤组织进行差异分析鉴定到31个DEGs,包括13个下调基因和18个上调基因(图1A)。为研究焦亡相关基因的相互作用,作者进行PPI分析(图1B)。作者发现CASP1, PYCARD, NLRC4, NLRP1, CASP5, NLRP3, CASP8和AIM2为核心基因。除CASP1基因外,其余基因均为DEGs。PPI网络中所有焦亡相关基因的相关性如图3C所示。
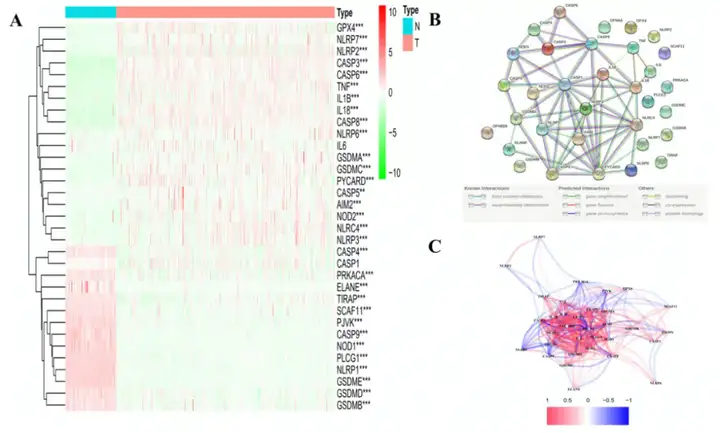
图1 33个焦亡相关基因的表达水平和互作
3.根据DEGs的肿瘤分型
为了研究这31个焦亡相关DEGs表达水平和OC亚型之间的关系,作者对TCGA队列的379个OC患者进行一致性聚类。作者发现K=2时,组内相关性最高而组间相关性最低,说明OC患者可以根据这DEGs分为两类(图2A)。聚类热图表明表明两个簇中的临床特征差异很小(图2B)。生存分析表明两个簇中的患者OS没有明显差异(图2C)。
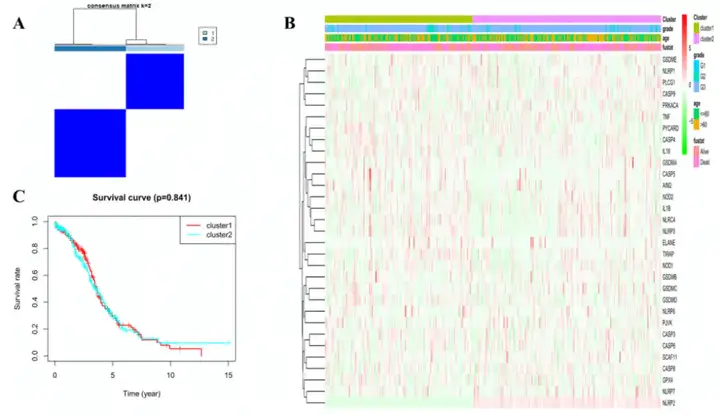
图2 基于DEGs的肿瘤分型
4. TCGA队列构建焦亡相关基因的预后模型
使用单因素Cox回归分析和LASSO筛选到7个焦亡相关基因(图3A-3C)。风险打分=(-0.187*AIM2)+(0.068*PLCAG1)+(0.097*ELANE)+(-0.143*PJVK)+(-0.086*CASP3)+(-0.033*CASP6)+(0.13*GSDMA)。根据风险打分中位数,将374例样本分为高风险组和低风险组(图3D)。PCA分型表明,两个分组可以完全区分开(图3E)。高风险组的患者生存时间较短且发生死亡的概率更高(图3F)。高风险组和低风险组的OS具有显著差异(图3G)。1年,2年和3年ROC曲线的AUC分别为0.628,0.662和0.607(图3H)。
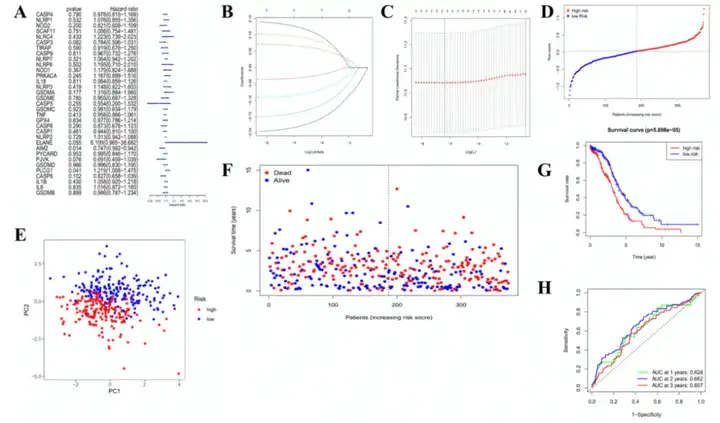
图3 构建TCGA队列的风险特征
5. 风险特征的额外验证
使用GEO队列共380例OC患者作为验证数据集,根据TCGA队列的风险打分中位数将GEO队列分为高风险组和低风险组(图4A)。PCA分析可以将GEO队列完全分为两组(图4B)。低风险组的生存率和死亡率较高(图4C)。生存分析表明高风险组和低风险组的生存率具有显著差异(图4D)。1年,2年和3年的ROC曲线的AUC分别为0.766,0.655和0.584(图4E)。
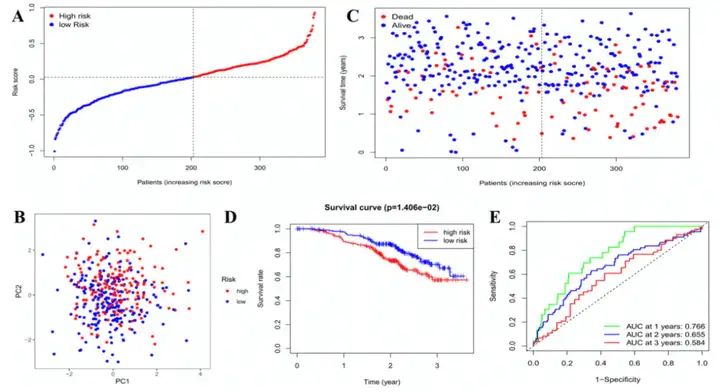
图4 GEO队列的验证
6. 风险模型可以作为独立的预后因子
随后,作者使用单因素和多因素Cox回归分析评估风险打分是否可以作为一个独立预后因子。单因素Cox回归分析表明风险打分可以作为预测生存较差的独立因子,多因素Cox回归分析表明风险打分可以作为一个独立预后因子(图5A-5D)。此外,作者使用聚类热图展示TCGA队列的临床特征和风险特征基因的表达水平(图5E)。
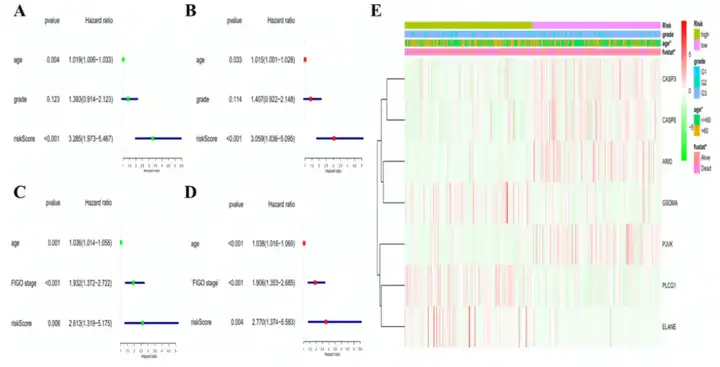
图5 风险打分的单因素和多因素Cox回归分析
7. 风险模型的功能分析
为进一步研究高风险组和低风险组之间的基因功能和通路的差异,作者使用limma包鉴定差异基因。高风险组和低风险组之间共鉴定到115个DEGs,其中包括66个上调基因和49个下调基因。对这些基因进行GO和KEGG分析,DEGs主要与免疫应答、趋化因子介导的信号通路和验证细胞趋化有关(图6A和6B)。
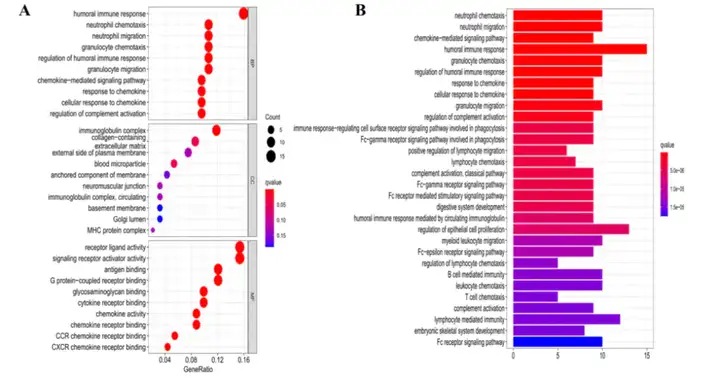
图6 DEGs的功能富集分析
8. 两个亚组的免疫活性的比较
此外,作者使用ssGSEA分析比较TCGA和GEO队列中高风险组和低风险组的16种免疫细胞富集打分和13条免疫相关通路的活性。TCGA队列中,高风险组的免疫细胞浸润水平较低,特别是CD8+ T细胞,中性粒细胞,NK细胞辅助T细胞和调节性T细胞(图7A)。除了2型IFN反应通路外,其余12种免疫相关通路在高风险组中活性较低(图7B)。GEO队列中,低风险组中树突状细胞,诱导树突状细胞和巨噬细胞富集程度较高,而2型IFN通路下调(图7C和7D)。
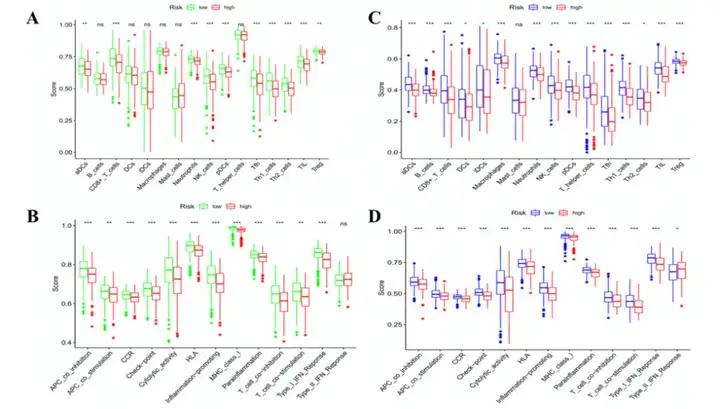
图7 两个亚组的免疫活性比较
结论
总的来说,作者的研究表明正常组织和肿瘤组织中焦亡相关基因的表达水平不同并且焦亡相关基因与OS有关。此外,作者使用Cox回归分析和LASSO分析构建了7个焦亡相关基因的风险特征。该风险特征可以将OC患者分为高风险组和低风险组且两组的OS具有显著差异。风险特征可以作为TCGA队列和GEO队列的独立预后因子。高风险组和低风险组之间的DEGs与肿瘤免疫有关。作者的研究为预测OC患者的预后提供了有用信息,为进一步研究OC中焦亡相关基因与免疫之间的关系提供了重要的基础。本文的亮点在于作者对焦亡相关基因进行研究,目前有关焦亡相关基因的研究较少。其局限性在于作者没有对这些焦亡相关基因进行实验验证。
版权声明:本文转自“生信发文助手”,文章转载只为学术传播,不代表本号观点,无商业用途,版权归原作者所有,如涉及侵权问题,请联系我们,我们将及时修改或删除。
 学术互动
学术互动

添加微信获取最新优惠、出版政策、课程直播信息,随时咨询客服/编辑,了解更多实时资讯


