 2021-08-15
2021-08-15 4843
4843
大家好!今天跟大家分享的文献是2021年7月发表在Molecular Therapy: Oncolytics (IF=7.200)杂志上的一篇文章。作者对子宫内膜癌的TCGA数据集进行分析构建可以准确预测高危三级子宫内膜癌的预后模型。
题目:Development of a seven-gene tumor immune microenvironment prognostic signature for high-risk grade III endometrial cancer
摘要
子宫内膜癌局部浸润了大量免疫细胞和肿瘤免疫微环境成分。这些细胞参与恶性肿瘤生长增殖和免疫疗法的耐药性。本文作者旨在使用TCGA数据集构建可以预测高危三级子宫内膜癌预后的肿瘤免疫微环境相关的预后模型。系统的分析了该模型与肿瘤微环境中免疫细胞浸润特征的相关性。作者根据该模型构建的列线图可以准确预测患者预后,且作者的模型比其他子宫内膜癌相关特征性能更好。对IMvigor210免疫治疗队列进行分析,其低风险组预后较好。低风险组具有免疫细胞浸润和炎症特征而高风险组具有疾病进展特征。ROC曲线表明结合风险打分、新抗原和TMB的模型可以准确预测治疗反应。总的来说,作者构建了一个基于肿瘤微环境的7-基因预后模型可以预测高危三级子宫内膜癌预后并指导更有效的免疫治疗策略。
流程图
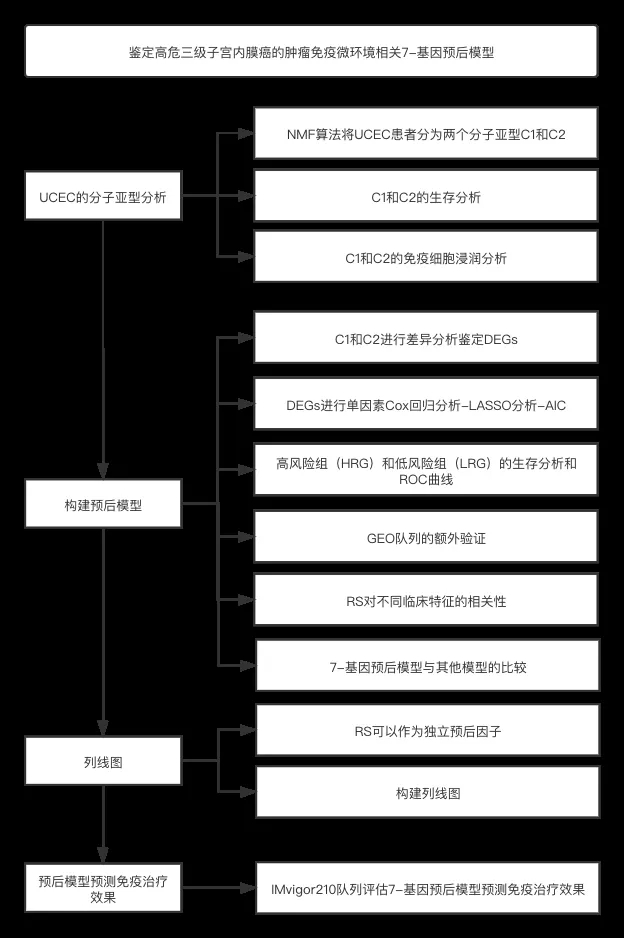
结果
1. 数据的获取和整理
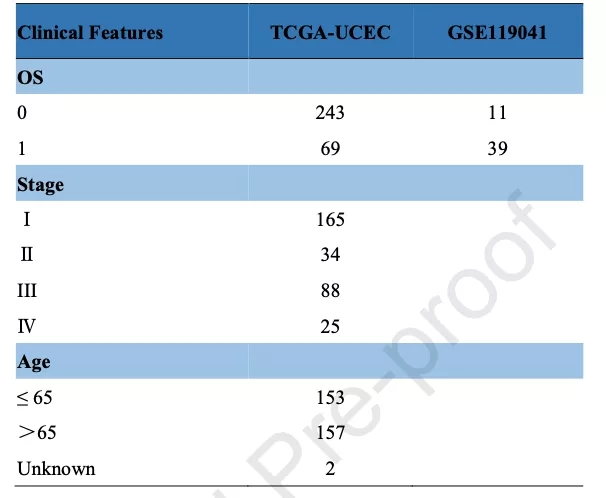
从TCGA数据库下载UCEC的基因表达谱数据(312例)和临床特征数据,从GEO数据库下载GSE119041队列(50例)(表1)。
表1 样本信息
2. 根据TIME基因鉴定两个分子亚组
经过滤和去重后作者得到一个包含1356个肿瘤免疫相关基因的表达矩阵并进行单因素Cox分析,鉴定到195个与UCEC预后有关的基因。使用NMF算法将UCEC患者分为两个亚组(图1A),生存分析表明C2的OS和PFS较差(图1B和1C)。使用ESTIMATE评估C1和C2的基质打分,免疫打分和ESTIMATE打分。此外,使用MCPcounter评估10类免疫细胞浸润比例,使用CIBERSORT评估22类免疫细胞浸润比例。ESTIMATE和MCPcounter结果表明C1的免疫浸润程度较高(图1E和1F)。CIBERSORT结果表明C1的M1巨噬细胞,CD8+ T细胞和滤泡T辅助细胞浸润比例较高(图1D)。因此,作者认为C1可能对免疫治疗效果较好。两个亚组的TIICs分布情况如图1G所示。此外,作者进一步比较了两个亚组组织病理学亚型、年龄、FIGO分期和生存情况的分布。
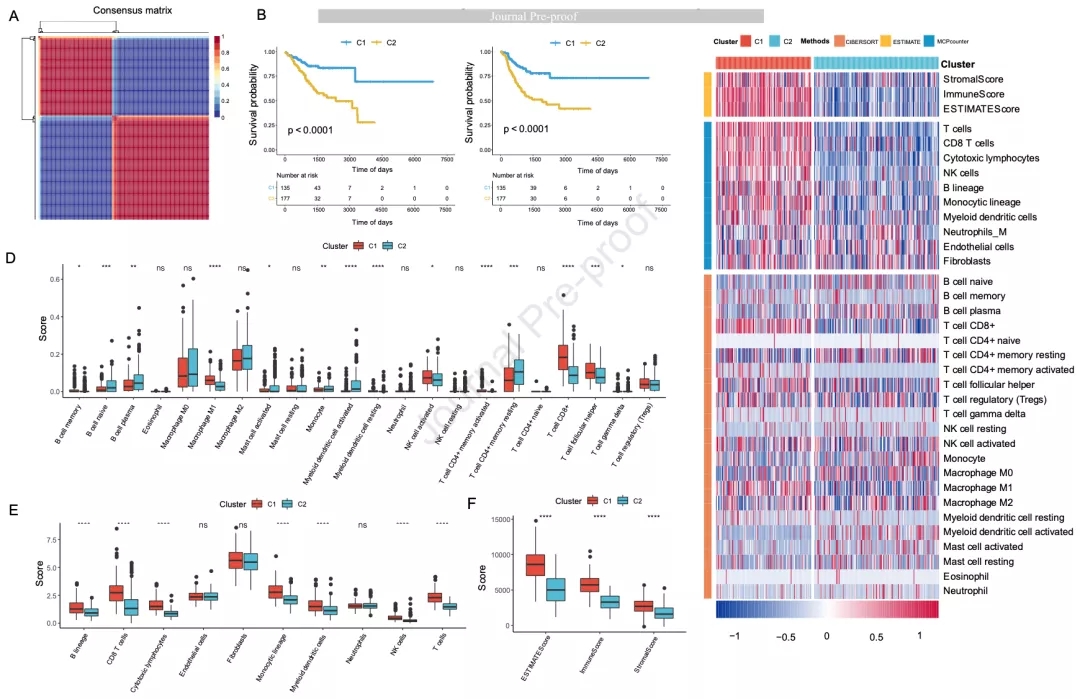
图1 根据TIME基因鉴定两个分子亚组
3. 鉴定两个亚组的DEGs
对C1和C2进行差异分析鉴定到883个DEG,包括443个上调基因和440个下调基因。
4. 根据TIME亚组构建预后模型
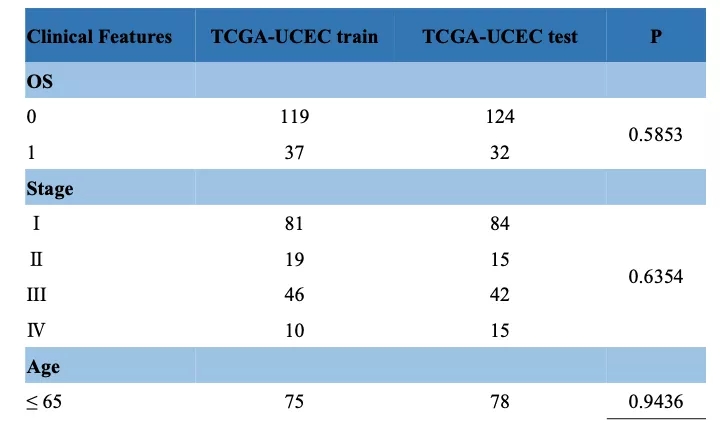
将TCGA队列随机分为训练集(156例)和验证集(156例)(表2)。
表2 TCGA训练集和验证集的样本信息
对训练集中的DEG进行单因素Cox分析鉴定到42个预后相关基因。这些基因可以作为潜在的TIME相关基因。随后进行LASSO分析得到18个基因(图2A和2B)。为获得模型的最佳拟合作者使用AIC方法,最终得到7个基因。风险打分(RS)=-0.621*DRAM1-0.343*TNFRSF14-0.106*SCGB2A1-0.433*EMX2 +0.259*DNER +0.248*DAPL1 +0.344*IFIT1。作者将RS大于0的样本列为高风险组(HRG),将RS小于0的样本列为低风险组(LRG)。KM生存分析表明HRG和LRG的生存率具有显著差异(图2C)。1年、3年和5年ROC曲线的AUC分别为0.79、0.82和0.89(图2D)。
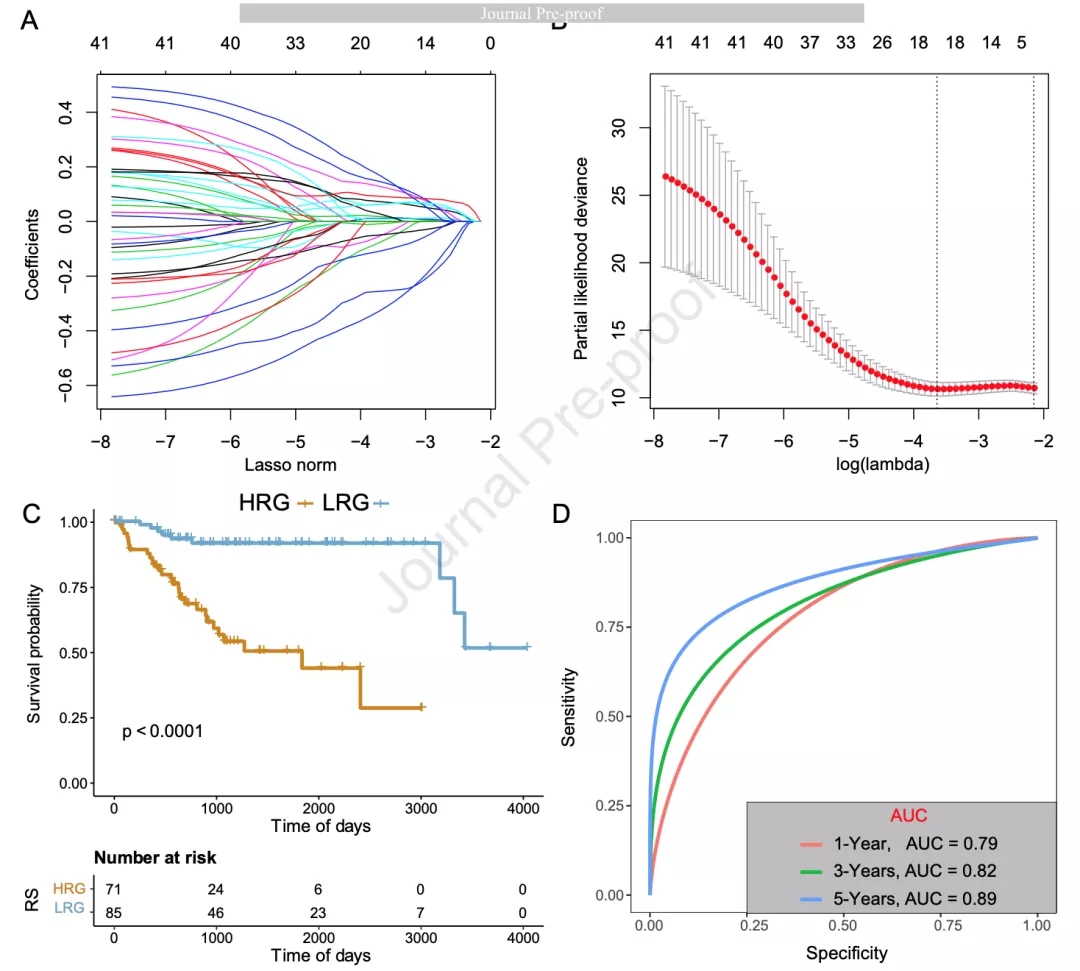
图2 LASSO回归分析
5. 预后模型的内部和外部验证
随后,作者对TCGA验证集和外部验证集GSE119041计算RS,将两个数据集分别分为HRG和LRG。TCGA验证集HRG和LRG的预后差异如图3A所示,1年、3年和5年ROC曲线的AUC分别为0.62、0.71和0.69(图3B)。对TCGA-UCEC整体队列进行同样分析,HRG和LRG预后差异如图3C所示,1年、3年和5年ROC曲线的AUC分别为0.72、0.77和0.8(图3D)。对GSE119041队列进行同样分析,HRG的预后较差(图3E),1年、3年和5年ROC曲线的AUC分别为0.76、0.79和0.78(图3F)。
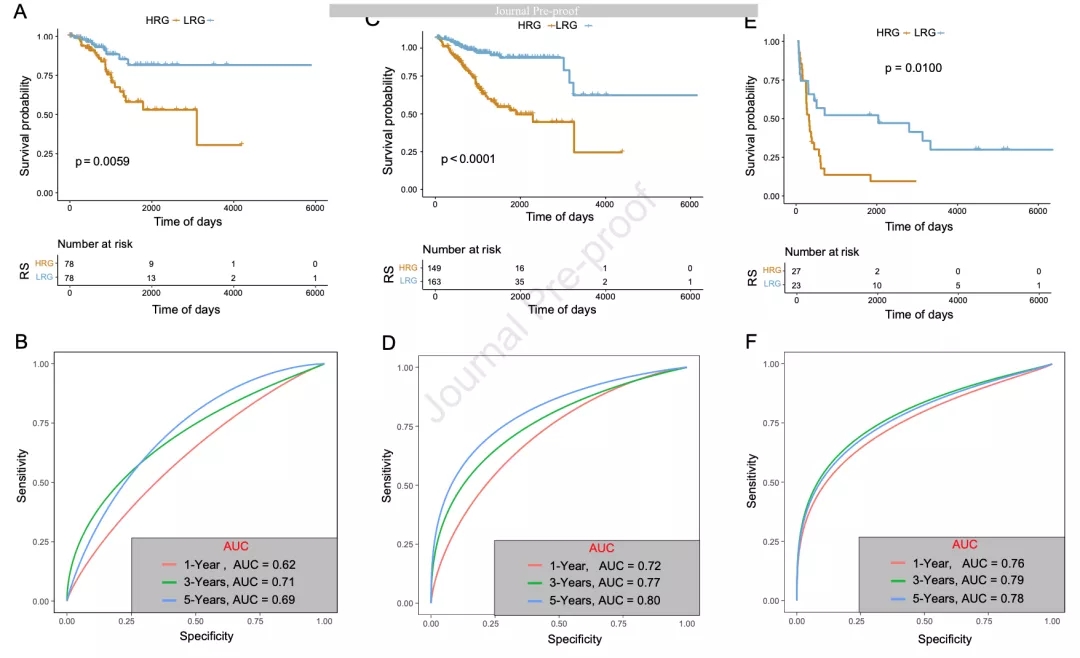
图3 预后模型验证
6. RS与临床特征的相关性
根据患者年龄和FIGO分期进行分组并基于RS将每个分组的患者分为HRG和LRG,其OS具有显著差异(图4A-4D)。年龄大于65岁的患者RS较高(图4E),FIGO Ⅳ期的RS最高(图4F),C2亚组的RS较高(图4G)。以上结果表明,作者的预后模型对不同临床特征具有较好的预后预测能力。使用GSEA分析研究风险打分与生物学通路的相关性(图4H和4I)。
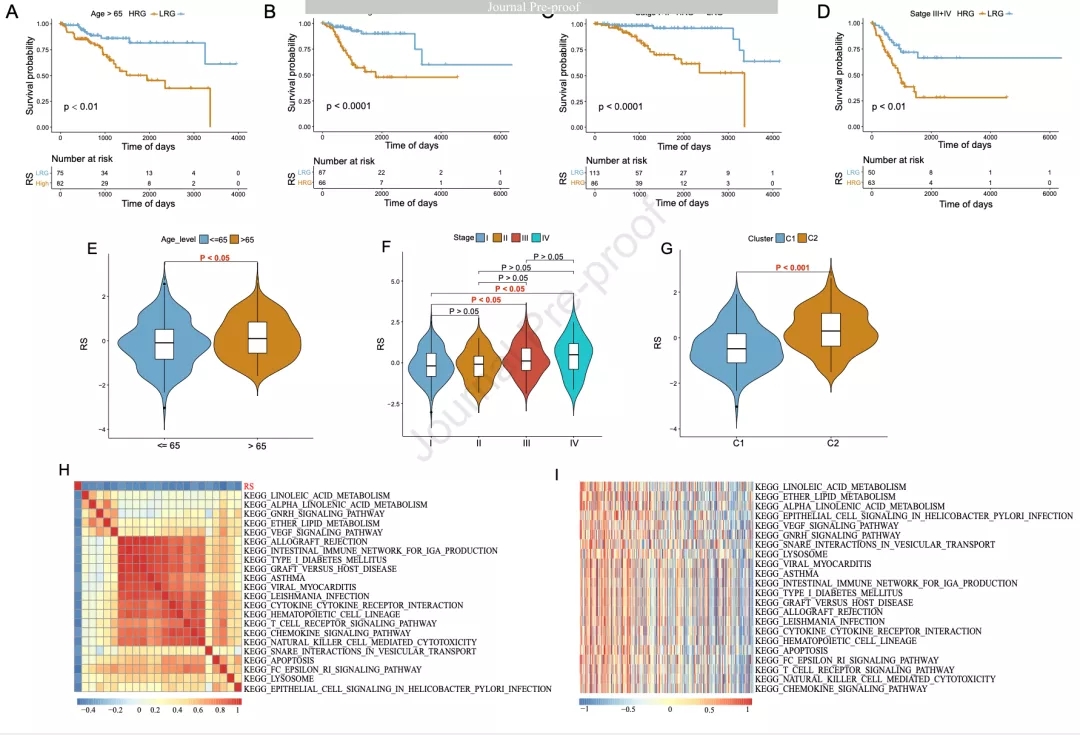
图4 根据预后模型的不同临床亚组的KM生存分析
7. 构建和验证列线图
单因素和多因素Cox回归分析表明RS是独立预后因子(图5A和5B)。多因素Cox回归分析结合FIGO分期和RS等临床特征构建列线图(图5C)。校准图表明列线图的预测性能较好(图5D)。列线图的1年、3年和5年的AUC均大于其他临床特征(图5E-5G)。使用决策曲线分析(DCA)评估预后模型的有效性,列线图的性能最好(图5H-5J)。以上结果表明列线图的预测预后性能最好,有助于临床决策和个性化治疗。
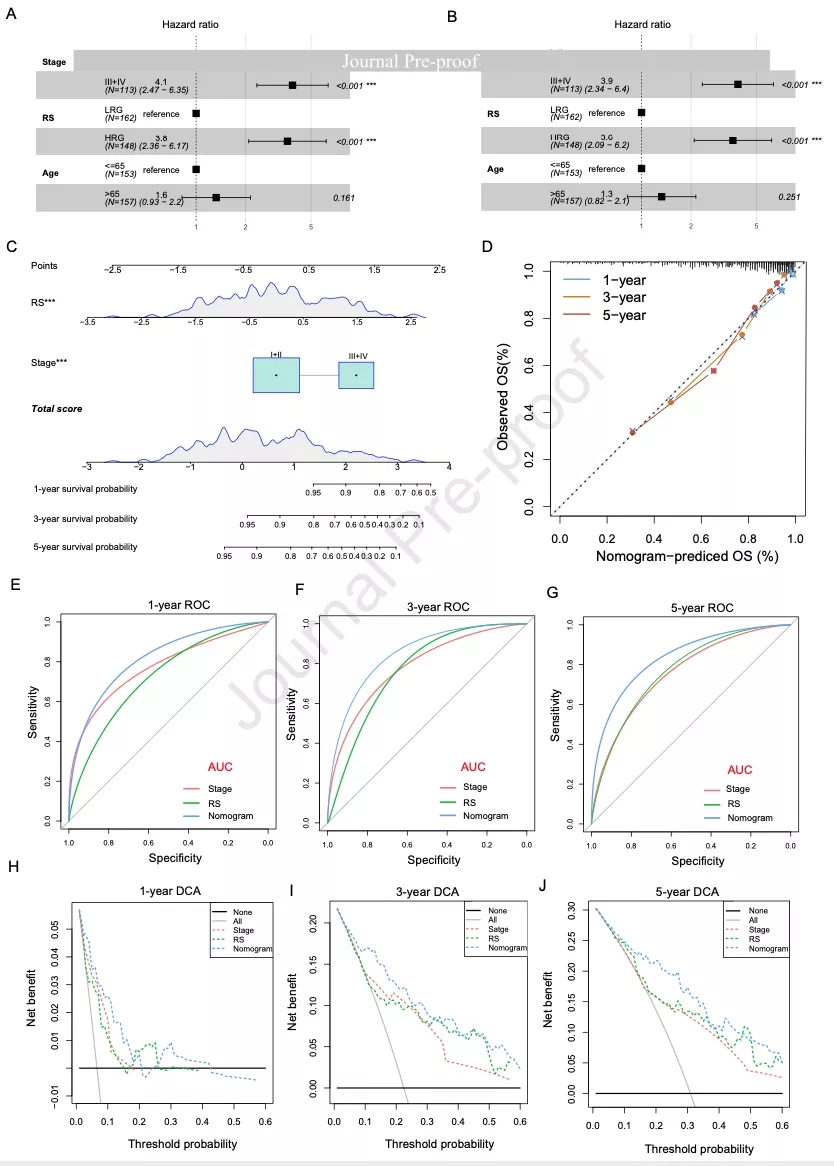
图5 预测模型的临床价值
8. 7-基因预后模型的性能比其他预后模型更好
为研究作者构建的7-基因预后模型对TCGA-UCEC队列的预测性能是否最好,作者使用已发表的4个预后模型与7-基因预后模型进行比较。这4个预后模型可以将患者分为两个风险分组(图6A-6C和6G)。ROC曲线表明,这4个预后模型的1年、3年和5年的AUC值低于作者构建的预后模型(图6D-6F和6H)。使用R包RMS计算C-index,作者构建的预后模型C-index最高(图6I)。
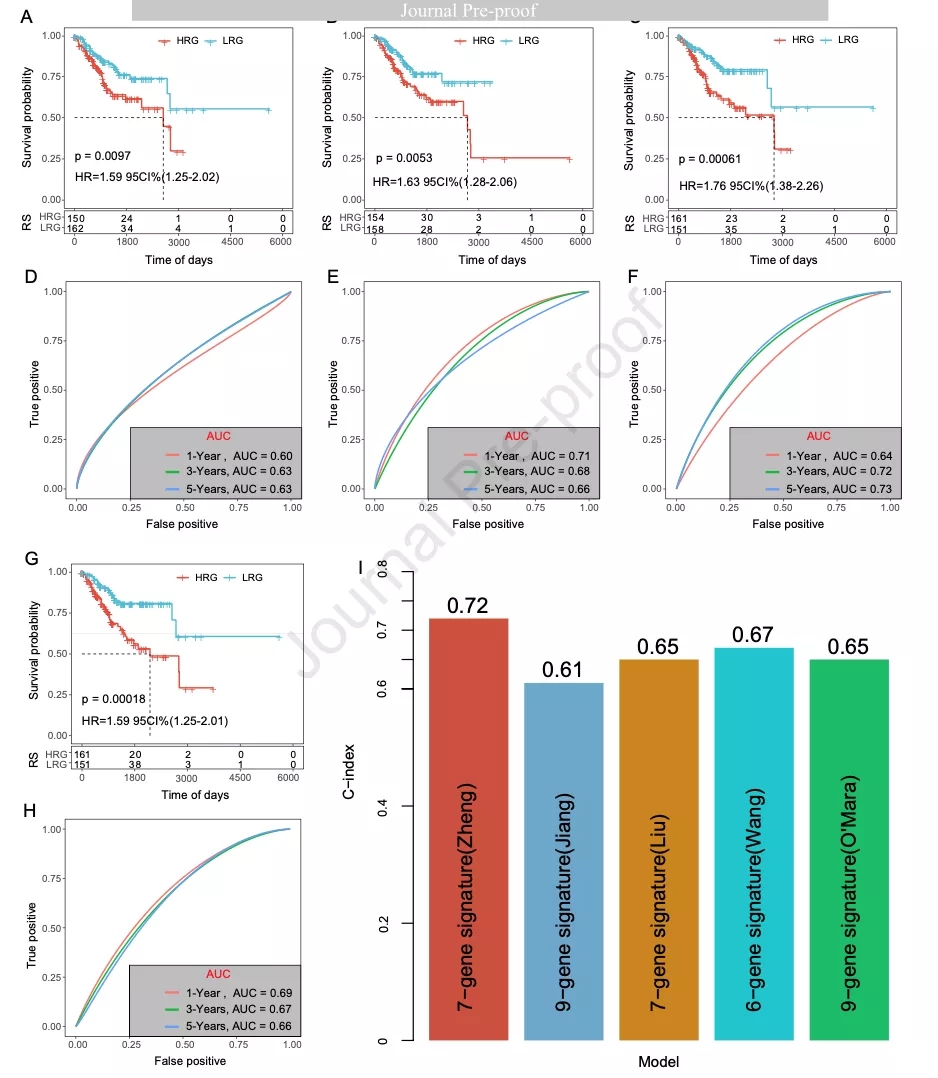
图6 7-基因预后模型与其他预后模型的比较
9.7-基因预后模型可以有效的预测化疗效果
作者使用免疫治疗队列(IMvigor210)研究预后模型是否可以预测免疫治疗效果。KM生存分析表明HRG患者预后较差(图7A)。ROC曲线表明结合RS、新抗原(NEO)和TMB的模型预测治疗反应的准确率较高(图7B)。使用MCPcounter计算IMvigor210队列的免疫细胞打分,结果表明RS与TMB、NEO和T细胞、NK细胞及B细胞打分负相关(图7C)。小提琴图表明,稳定疾病(SD),进展疾病(PD)患者的RS显著高于完全缓解(CR)和部分缓解(PR)患者(图7D)。LRG中CR/PR患者比例高于HRG(图7E)。因此,LRG患者的免疫治疗反应较好。
此外,作者分析了RS相关的免疫活性并评估了RS与不同炎症和免疫反应功能的相关性。RS与HCK、LCK、MHC-Ⅱ、MHC-Ⅰ负相关,与干扰素正相关(图7F)。随后,作者分析了风险打分与22种免疫细胞浸润比例的关系,HRG和LRG两组的免疫细胞浸润比例不同,HRG中CD8+ 细胞和M1巨噬细胞浸润比例较高(图7G和7H)。
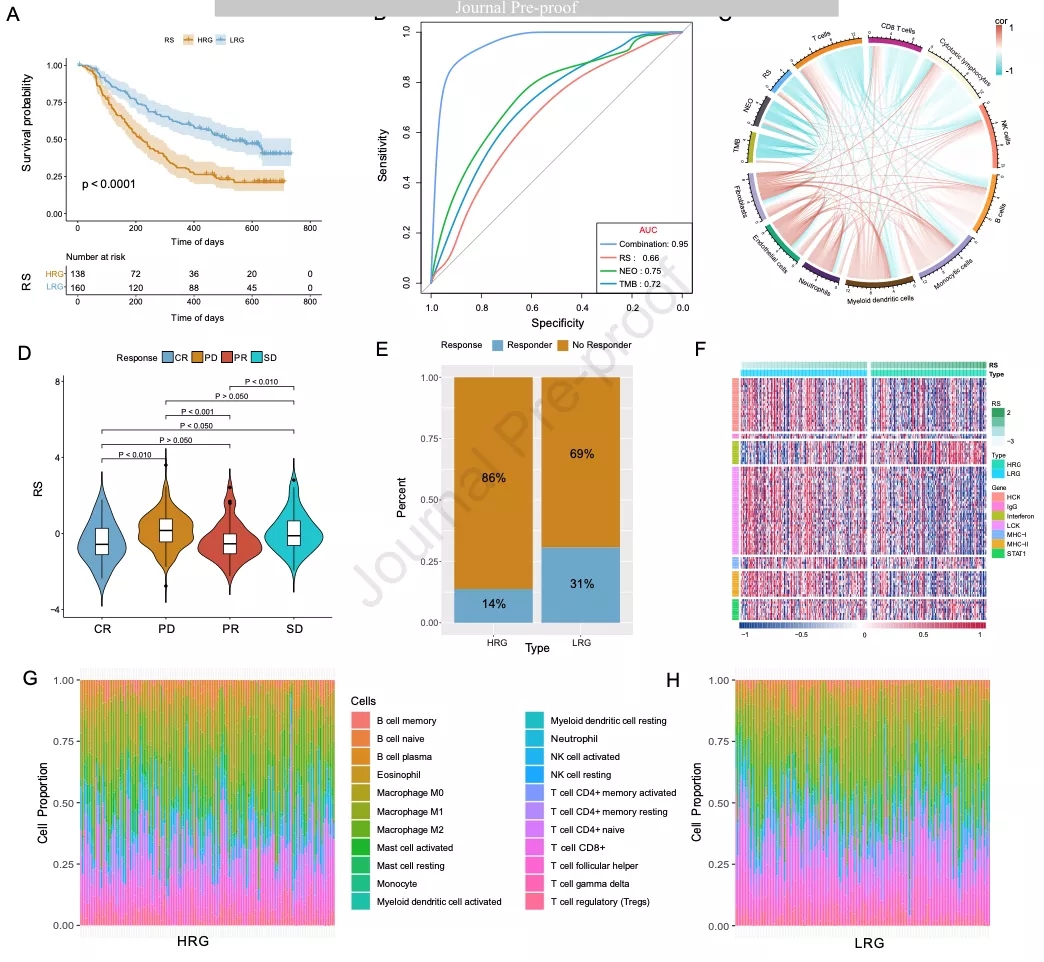
图7 预测化疗反应
结论
总的来说,作者根据免疫相关基因将高危三级UCEC患者分为两个亚组。C1有益于免疫治疗。随后,作者构建并验证了7-基因预后模型,该预后模型对训练队列和验证队列具有良好的预测性能。该预后模型可以作为一种重要的临床工具可以用于预测高危三级UCEC患者的预后和免疫治疗效果。本研究还存在一定局限性,例如还需要qRT-PCR或免疫组化等试验验证本研究鉴定到的7个基因的表达情况。
版权声明:本文转自“生信分析”,文章转载只为学术传播,不代表本号观点,无商业用途,版权归原作者所有,如涉及侵权问题,请联系我们,我们将及时修改或删除。
 学术互动
学术互动

添加微信获取最新优惠、出版政策、课程直播信息,随时咨询客服/编辑,了解更多实时资讯


